摘要:
回肠巨大炎性纤维性息肉致肠套叠1例并文献复习胡龙飞(平阳县人民医院病理科浙江温州325400)摘要:目的 探讨病理对胃肠道炎性纤维性息肉(IFP)的诊断。方法 回顾性分析1例IFP临床、病理学形态及免疫组织化学标记,复习相关文献。结果 本例患者女性,51岁,反复腹痛伴肠套叠,肠镜表现为肿物呈息肉状,向腔内杵状生长。回肠巨大炎性纤维性息肉致肠套叠1例并文献复习
胡龙飞
(平阳县人民医院病理科 浙江温州325400)
摘要:目的 探讨病理对胃肠道炎性纤维性息肉(IFP)的诊断。方法 回顾性分析1例IFP临床、病理学形态及免疫组织化学标记,复习相关文献。结果 本例患者女性,51岁,反复腹痛伴肠套叠,肠镜表现为肿物呈息肉状,向腔内杵状生长。镜下病变由小的薄壁血管和长梭形细胞构成,间质疏松水肿伴嗜酸性粒细胞为主,息肉表面伴溃疡形成。免疫组化显示病变组织表达纤维和肌纤维母细胞标记Vim(+) ,SMA(+)。患者行肿物切除术,术后9个月随访无复发。近年来,IPF相关发生机制的研究与 PDGFRA基因突变有关。结论 IFP 是胃肠道少见的良性病变,临床表现多表现为腹痛,小肠病变常因肠梗阻、肠套叠等并发症为首发表现。手术切除或内镜下摘除为其主要的治疗方法。确诊胃肠炎性纤维性息肉诊断首选病理。
关键词:回肠;胃肠道炎性纤维性息肉;跨壁生长;PDGFRA基因
1资料与方法
1.1资料 患者女性,51岁 反复腹痛1月余,加重2天入院,无既往病史及家族史,体检:体温37℃,脉搏81次/分,呼吸19次/分,血压151/81mmHg。实验室检查:急诊血常规+急诊CRP:白细胞计数12.5↑[10^9/L],中性粒细胞86.6%↑,血小板计数312↑[10^9/L],超敏CRP25.4[mg/L],AFP,CEA,CA125,CA199 均正常。辅助检查:我院急诊就诊,查腹部CT提示:“回肠末端-回盲部肠套叠,请结合肠镜及增强检查除外占位。
1.2 方法 标本经4%中性甲醛液固定,常规石蜡包埋切片4um厚,HE染色和免疫组化染色,免疫组化使用 EnVision二步法,所用试剂盒均购自福州迈新生物技术开发有限公司。
2结果
2.1巨检:小肠一段长28厘米,距小肠断端11厘米,距回盲瓣12厘米,肠壁黏膜面见一杵状隆起息肉大小3*2厘米,高出肠腔6厘米。
2.2镜检:肿物表面被覆少量残存粘膜上皮,部分区域粘膜坏死脱落,粘膜脱落处见大量炎性坏死组织形成的糜烂溃疡,肿瘤细胞长梭形,间质疏松水肿,可见小的薄壁血管伴少量嗜酸性粒细胞,本例出现跨壁生长,累犯肌层并侵犯浆膜下层。
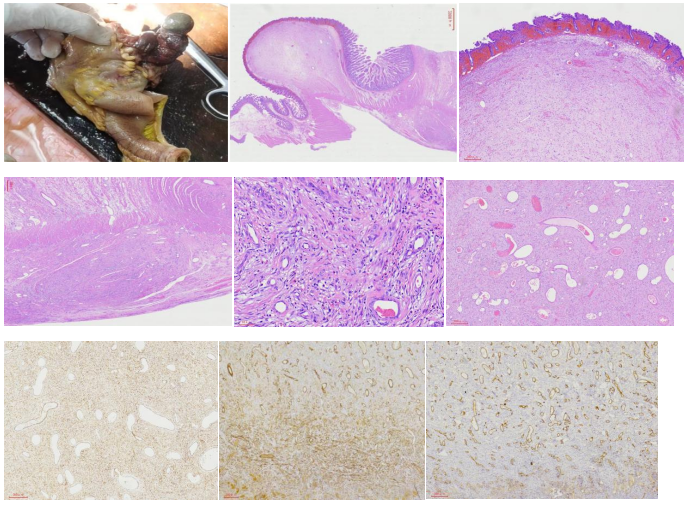
图1:常规取材大体标本 图2低倍镜下肿物息肉状形态 图3肿物表面伴糜烂溃疡 图4瘤细胞跨壁生长,穿透固有肌层至浆膜下层 图5瘤细胞呈长梭形围绕小血管,间质伴少量嗜酸粒细胞浸润 图6 肿瘤间质小血管丰富,“洋葱皮”不明显。
2.3免疫组化:Vimentin阳性(图7),SMA部分阳性(图8),CD34阴性(图9),ki-67增殖指数约1%,CK,CD117,Dog-1,S100,CD99,EMA,SOX10,calretinin,Desmin,BCL-2均阴性。
2.4病理诊断:(右半结肠切除标本)回肠炎性纤维性息肉,病变累犯肌层并侵犯至浆膜下层。
3讨论
3.1病因及发病机制
炎性纤维性息肉( Inflammatory fibroid polyps,IFP),也称为 Vanek 肿瘤,由 Vanek[1]于1949 年首次描述,临床较为少见,是一种发病机制尚不明确的良性肿瘤。1953 年Helwing 等[2]将该病命名为炎性纤维性息肉并被广泛接受。IFP原来一直被认为是良性反应性增生,后来研究表明PDGFRA基因突变可能是IFP的重要致病机制[3-4],尽管并非所有 IFP 都具有 PDGFRA 突变,但现在假定它们是真正的肿瘤 ,因此其在WHO( 2010) 消化道肿瘤病理学和遗传学分类中被归为良性间叶源性肿瘤[5]。
3.2资料复习及治疗方法
IFP可发生在胃肠道的任何部位,多发生于胃窦和回肠[6],通常无临床症状,大多在内镜下偶然发现,但有小肠病变的患者经常表现为肠套叠。2020年[7]一篇针对77例小肠IFP的系统性综述显示,患者年龄从4岁到75岁(平均45.2岁);女性为主(59.7%);大体表现可有蒂或无蒂,直径0.2-20 厘米不等;最常见的定位是回肠(77.9%),其次是空肠(13%)和十二指肠(6.5%);最常见的临床表现是肠套叠引起的腹痛 (63.6%) 。 在诊断方法方面,CT经常被用作主要诊断方法(26%),其次是剖腹探查术 (16.9%) ,内窥镜检查 (7.8%)和超声检查(6.5%) 。 小肠IFP大多数采用手术治疗(92.21%),只有少数采用内窥镜等微创技术治疗。
3.3病例回顾与诊断要点
本病例患者女性,51岁,临床表现为肠套叠引起的腹痛,肿物位于回肠,因肿物较大,故行手术切除。“洋葱皮”和大量嗜酸性粒细胞是IFP典型形态学特征。免疫组化CD34常阳性表达。然而,有些病例“洋葱皮”和 CD34 表达都不存在[8] 。本病例“洋葱皮”不明显,且CD34无表达。
3.4鉴别诊断
①胃肠间质瘤(GIST):组织学分为梭形细胞型,上皮样细胞型及混合型,其中梭形细胞型形态学与IFP类似,发病部位及大体形态相似,PDGFRA均呈阳性,GIST多表达CD117,DOG-1,存在KIT基因突变。
②炎性肌成纤维细胞瘤:多发生于儿童,青少年和青年人,发生于胃肠道外,多数ALK阳性。
③神经束膜瘤:常见板层状、席纹状或漩涡状生长,EMA阳性,claudin-1阳性,无PDGFRA基因突变。
4结论
IFP被认为是良性的,很少复发或转移。因此,不推荐进一步诊断和随访。除非肿瘤有症状,否则不建议进行手术治疗。腹腔镜探查或剖腹手术是肠套叠病例的首选。如果发生完全性肠梗阻,应尽快进行手术治疗,以防止内陷肠段发生缺血、坏死以及随后可能的穿孔。从形态上看,IFP 以黏膜下层为中心,通常观察到 IFP 穿过黏膜肌层的黏膜延伸,很少有病例观察到浸润固有肌层,延伸到固有肌层之外,即浆膜下层或外膜更是罕见。然而,最近发表的三例病例报告显示IFP侵入甚至侵出固有肌层,其中一例在回肠 [9],两例在胃中 [10, 11],本回肠病例也侵出固有肌层至浆膜下层。这些发现意味着 IFP可能偶尔表现为浸润性生长的局部侵袭性肿瘤,具有恶性潜能,可能在切除不充分后表现为局部复发,这些肿瘤的生物学行为还需要大样本病例来验证。观察到 IFP的侵袭性特征,应仔细考虑治疗策略,以避免治疗不足。
参考文献
[1].Vanek J. Gastric submucosal granuloma with eosinophilic infiltration. Am J Pathol. 1949;25:397–411.
[2].Helwing E B,Ranier A. Inflammatory fi- broid polyps of the stomach[J]. Surg Gy- necol Obstet,1953,96( 3) : 335-367.
[3].Schildhaus HU, Cavlar T, Binot E, Büttner R, Wardelmann E, Merkelbach-Bruse S. Inflammatory fibroid polyps harbour mutations in the platelet-derived growth factor receptor alpha (PDGFRA) gene. J Pathol. 2008;216:176–82
[4].Lasota J, Wang ZF, Sobin LH, Miettinen M. Gain-of-function PDGFRA mutations, earlier reported in gastrointestinal stromal tumors, are common in small intestinal inflammatory fibroid polyps. A study of 60 cases. Mod Pathol. 2009;22:1049–56.
[5].周晓军,樊祥山. 解读 2010 年消化系统肿瘤 WHO 分类( Ⅰ) [J]. 临床与实验病理学杂志,2011,27( 4) : 341-346.
[6].GARMPISN,DAMASKOSC,GARMPIA,etal.In-flammatoryfibroidpolypofthegastrointestinaltract: Asystematicreviewforabenigntumor[J].InVivo, 2021,35:81-93.
[7].Ivani N,Tomas V,Vranic' L,et al. Inflammatory fibroid polyp of the small intestine: a case report and systematic literature review [J]. J Gastrointestin Liver Dis,2020,29( 3) : 455-460.[8].Liu TC, Lin MT, Montgomery EA, Singhi AD. Inflammatory fibroid polyps of the gastrointestinal tract: spectrum of clinical, morphologic, and immunohistochemistry features. Am J Surg Pathol. 2013;37:586–92.
[9]. Tajima S, Koda K. Locally infiltrative inflammatory fibroid polyp of the ileum: report of a case showing transmural proliferation. Gastroenterol Rep (Oxf) 2018;6:144-148.
[10]. Lee JH, Yoo JS, Jung HY, et al. A case of invasion of Muscularis Propria of gastric inflammatory fibroid polyp. Korean J Helicobacter Up Gastrointest Res 2015;15:254–257.
[11]. Harima H, Kimura T, Hamabe K, et al. Invasive inflammatory fibroid polyp of the stomach: a case report and literature review. BMC Gastroenterol 2018;18:74.