摘要:
四川绵阳四0四医院四川绵阳 621000摘要:目的:对比研究应用不同的抗原修复方法对免疫组化染色结果产生的影响。方法:选取2015年1月——2021年12月间我院48例大肠癌手术切除的组织,采取不同抗原修复方法(高压加热、煮沸、胰酶消化法)进行免疫组化染色,对比不同抗原修复方法下的免疫组化染色结果。结果:不同四川绵阳四0四医院 四川绵阳 621000
摘要:目的:对比研究应用不同的抗原修复方法对免疫组化染色结果产生的影响。方法:选取2015年1月——2021年12月间我院48例大肠癌手术切除的组织,采取不同抗原修复方法(高压加热、煮沸、胰酶消化法)进行免疫组化染色,对比不同抗原修复方法下的免疫组化染色结果。结果:不同抗原修复方法产生的染色结果具有较大差异,使用高压加热的修复方法阳性率明显较高。结论:在抗原修复方法选择上,高压加热修复效果明显,适用性和准确度高。
关键词:抗原修复方法;免疫组化;染色结果
免疫组化技术在临床病理诊断、鉴别等方面发挥着极其重要的作用,其主要依据抗体与抗原的反应,使用显色剂标记反应抗体,便可进行抗原的鉴定[1]。该检测技术具有较高的灵敏度,操作简洁,在临床上的应用比较广泛。而在实际操作中,免疫组化获得的染色结果往往受到多方面的影响,基于大量的经验和研究,抗原修复方法会对染色结果与质量产生较大影响。为此,本文对不同抗原修复方法对免疫组化染色结果的影响展开研究,现报告如下。
1 资料与方法
1.1 一般资料
本次研究选取48例大肠癌手术切除的组织标本作为研究对象,选取时间为2015年1月至2021年12月。所有组织标本均经石蜡包埋、福尔马林常规固定,为连续切片,约为3~4μm厚。
1.2 方法
将所有切片组织60℃烤片过夜。对所有组织均采取三种修复方法进行修复,观察染色结果。
(1)高压修复法。使用环保透明剂脱蜡3缸,每缸5分钟,梯度酒精为100%、100%、95%、80%,每缸2min。配置EDTA抗原修复液(50倍稀释)将组织切片放置于抗原修复盒中,盖紧盖子,再放入高压锅中,需要注意高压锅中水的高度,防止抗原修复盒倾倒。待高压锅气阀冒气后,计时7分钟,快速放气并拿出盒子,自然冷却至室温。使用PBS清洗,每次2min;3%过氧化氢,室温孵育10min;在进行PBS清洗3次,每次2min。(2)加热煮沸抗原修复法。将组织切片放置进装有抗原修复液的电炉中进行处理,待温度上升至92℃时,拔掉电源,温度下降后再次插上电源,使温度始终保持在92℃的范围内,高温煮沸持续10min。待修复液温度恢复至室温后,进行PBS冲洗三次。(3)胰酶消化法。使用0.1%的胰蛋白酶消化液进行组织切片水浴消化,水温为37℃。消化时间需要结合组织的新鲜程度来确定,一般新鲜组织需要消化5min,固定时间在半年内的组织消化时间为10min,固定半年以上的陈旧组织,消化时间为20min[2]。消化处理完成后,用PBS缓冲液进行冲洗.
对每组切片进行3%过氧化氢室温孵育10min,然后滴加一抗,放入冰箱过夜。PBS缓冲液冲洗组织切片三次,擦干后滴加二抗试剂,37℃烤箱孵育20min。PBS洗后擦干,滴加DAB显色剂,于显微镜下观察控制显色[3]。
1.3 观察指标
观察组织切片在不同抗原修复方法下的阳性率,进行对比。
1.4 统计学分析
此次研究以SPSS21.0统计学软件为数据分析处理工具,用(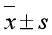 )表示计量资料,进行t检验,用(n,%)表示计数资料,进行c2检验,P<0.05表示差异具有统计学意义。
)表示计量资料,进行t检验,用(n,%)表示计数资料,进行c2检验,P<0.05表示差异具有统计学意义。
2 结果
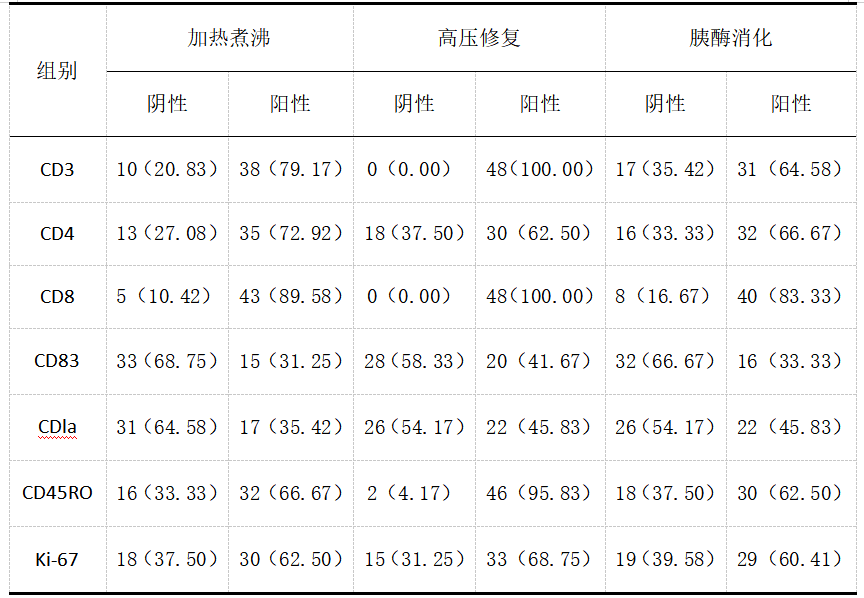
由表1可知,高压修复的阳性率明显较高。
表1不同抗原修复方法的切片免疫组化染色结果
3 讨论
免疫组织学,是结合免疫学与病理形态学的一门新兴学科,也是现代生物医学中的一项重要方法。免疫组织化学染色法,是结合荧光或可呈色的化学物质进行抗原检测,利用抗原与抗体间的转移性结合反应,来检测细胞或组织中是否存在抗原目标[4]。该方法具有成本低廉、简单便捷、灵敏度与专一度高的优势,经常用于特定的肿瘤标记,用来筛选癌症,免疫组织化学染色技术为当前的病理学诊断提供了重要依据,已成为诊断的重要手段之一[5]。在免疫组化修复中,抗原是一种能够刺激机体产生抗体同时能够与抗体发生特异性结合的物质,这种物质所具有的性质即为抗原性,一般情况下,分布于抗原表面的抗原决定簇能够对其起决定性作用。而抗原修复即是在进行石蜡切片免疫组化染色前,使用金属盐、酶、表面活性剂等物质,对已经变性的抗原或者被掩盖的抗原决定簇实现暴露和修复,而使得相应的抗原性在一定程度上得到恢复[6]。经过大量研究实验发现,标本的固定时间越长,其形成的交联越紧密,抗原的激活难度就越大,在这一过程中,需要更强的修复强度。另一方面,标本固定时间越长,其组织中的蛋白温度耐受力就会提升,因此,在进行抗原修复时,要求关注修复的条件,通过延长修复时间、提高修复温度的方式来保证修复的效果。实际抗原修复染色中,染色成败除了与组织的抗原保存时间有关外,修复时选用的抗原修复方法有对染色结果会产生较大影响。当前最常用的抗原修复法为高温和高压修复的方法,高压修复具有修复时间短,温度和染色均匀、定位准确、结果可靠等优势,近年来受到了越来越多研究者的青睐[7]。为了获得更加理想的免疫组化染色效果,本次研究对抗原修复方法这一影响因素进行探讨。主要应用了高压修复、加热煮沸、胰酶消化法三种方法进行修复,对比其染色的结果,以获取最佳的抗原修复方法。
本次研究选取48例大肠癌组织标本,分别采取加热煮沸、高压修复和胰酶消化三种抗原修复方法进行修复,对比免疫组化染色结果。经对比,使用高压修复法的阳性率高于其他两组修复方法,
基于本次研究,不同的抗原修复方法的免疫组化染色结果差异较大,而高压修复法的染色质量明显优于其他两种方法,可扩大其应用范围,值得进一步研究。
参考文献
[1]虞飞,冯立文,项鹏程,岳林,白雪峰.不同抗原修复方法在淋巴瘤免疫组化检测中的应用[J].诊断病理学杂志,2019,26(09):622-623.
[2]郑秋桦,李钰湘,柯野,等.3种抗原修复方法对免疫组化染色效果的影响[J].韶关学院学报,2017,38(12):51-54.
[3]黄建平,杨映红,吴雪晶.不同抗原修复法对免疫组化HBcAg染色结果的影响[J].临床与实验病理学杂志,2017,33(05):577-578.
[4]何丹,王杜娟,曾丽华,等.不同抗原修复方法在免疫组化染色中的应用[J].深圳中西医结合杂志,2015,25(15):35-36.
[5]邹琼瑜,叶琼,陈丽雅.不同抗原修复方法在陈旧性石蜡切片乳腺珠蛋白免疫组化中的比较[J].中国微生态学杂志,2016,28(12):1429-1432.
[6]刘鲜艳, 郝斌威, 马爱玲,等. 不同抗原修复方法对层粘连蛋白免疫组化染色结果的影响[J]. 临床与实验病理学杂志, 2015, 31(2):2.
[7]闫红娟, 马晓平, 李曼,等. 不同抗原修复方法对食管鳞癌组织中ANO1蛋白染色的影响[J]. 农垦医学, 2017, 39(4):4.