摘要:
广东省佛山市复星禅诚医院科室:检验科 邮编:528000,[摘要]目的:分析多通道实时荧光定量聚合酶链反应(PCR)在人乳头瘤病毒(HPV)DNA中的检测效果。方法: 分析临床在 2022 年 6 月至 2023 年的 5092例采用多通道实时荧光定量 PCR仪广东省佛山市复星禅诚医院 ![]()
科室:检验科 邮编:528000 ,
[摘要]目的: 分析多通道实时荧光定量聚合酶链反应( PCR) 在人乳头瘤病毒 ( HPV)DNA 中的检测效果。方法: 分析临床在 2022 年 6 月至 2023 年的 5092 例采用多通道实时荧光定量 PCR 仪进行 HPV DNA 分型及定量检测的宫颈分泌 物标本, 并收集常见的 8 种高危 HPV 各浓度梯度的标本进行可靠性分析。8 种 高危 HPV 型分别为主要高危型 HPV16、HPV18、HPV56、HPV53、HPV51、 HPV52、HPV58、 HPV39 。结果: 随机重复试验对每个型別的各浓度标本进行 的重复性试验每次扩增均为阳性 ,型別符合率为 100%。结论: 多通道实时荧光 定量 PCR 检测 HPV DNA 可对 HPV 分型进行准确鉴别,有助于为临床针对宫颈
病变实施定量检测和疾病诊断提供指导。
关键词: 多通道实时荧光定量 PCR; HPV DNA; 宫颈病变; 疾病诊断
人乳头瘤病毒( Human papillomavirus, HPV) 属于乳多空病毒科 A 亚群 内 DNA 病毒, 不但可造成人体皮肤及黏膜上皮细胞感染 ,还可诱发上皮细胞增 殖性病变以及乳头瘤样改变, 高危型 HPV 感染与宫颈癌、癌前病变存在重要关 联[1] 。宫颈病变与宫颈感染患者 HPV 负荷量存在重要关联, 临床可通过检测 HPV 负荷量对患者病情严重程度及疾病类型进行评估[2] 。多通道实时荧光定量 PCR 检测方法为临床实施 HPV DNA 感染的常用手段, 可通过具有不同激发/发 射波长的荧光物质对通用型或者不同特异性探针进行示踪,能够于同一反应管中 检测不同基因型别, 有助于临床早期明确诊断女性人群 HPV 感染, 同时也能够 为临床明确病毒载量以及判断患者预后提供指导[3] 。本次研究选取 40 例在本院 进行 HPV DNA 检测的研究对象 ,研究时间为 2022 年 6 月至 2023 年 6 月 ,观
察和分析多通道实时荧光定量 PCR 在 HPV DNA 中的检测价值, 如下:
1 材料与方法
1.1 标本来源
分析自 2022 年 6 月-2023 年 6 月在本院进行 HPV 分型与定量检测的 527 例阳性分泌物标本 。从常见的八个型别中选取各个型别定量值为 103 104 105
106 107 的标本共 40 个, 重复进行荧光定量 PCR 检测。
1.2 仪器和试剂
ABI7500 荧光定量 PCR 扩增仪, 荧光定量试剂为硕世生物的人乳头瘤核酸
分型检测试剂盒 ,样本要求如下:
(1) 样本类型: 宫颈脱落细胞;
(2) 样本采集: 采样前用棉拭子轻轻擦拭宫颈口过多的分泌物, 将宫颈 采样刷伸入宫颈口鳞柱上皮交界处,顺时针或逆时针旋转 3-5 圈采集宫
颈脱落细胞 ,将其放入标有病人编号的取样管中, 密闭送检。
(3) 样本保存和运输:样本采集后应及时检测 ,2℃-8℃保存 3 天内完成 检测,-20 士 5℃保存不超过 12 个月。样本避免反复冻融,冻融次数不
能超过 5 次。
1.3 方法
对所选标本实施多通道荧光定量 PCR 检测 。从-80 冰箱取出收集的标本后 于室温下复溶,于 72h 内实施 DNA 提取,将标本置于震荡器上震荡并使标本混 匀,取 1mL 并置于离心管中,离心速度:13000r/min、半径:8cm、时间:10min, 弃除上清液取沉淀物, 将 50μL DNA 提取液加入至沉淀物中, 然后震荡混匀 。 于 100℃金属浴, 时间: 10min, 转速: 13000r/min, 时间: 5min, 完成离心
后, 上清液即为所需要用到的核酸。试剂则按照试剂盒说明书进行合理分配。
主要以人乳头瘤病毒基因组 L1 区为靶区域, 设计 21 个型别特异性引物和 探针 ,分别以 FAM、HEX、ROX 标记相应型别 ,探针为包括了 5’端报告基团和 了 3’端淬灭基团的寡核昔酸 ,在 PCR 扩增过程中 ,当探针完整时, 由于淬灭基 团轮近报告基团,报告基团发出的荧光被淬灭基团吸收,不发出荧光信号。引物 延伸时, 与模板结合的探针被 Tag 酶( 5'->3-外切核酸酶活性)切断, 报告基 团与淬灭基团分离 ,产生荧光信号, 荧光定量 PCR 仪根据检测到的荧光信号自 动绘制出实时扩增曲线,从而实现对人乳头瘤病毒在核酸水平上的定性检测。同 时参考基因可以用于监控并排除由于仪器故障、试剂因素、操作不当或样本中的 抑制物等因素造成的假阴性结果。配完试剂后加入备好的核酸溶液 2ul 于反应孔
中并应用实时荧光定量 PCR 进行检测, 分别实施阴性阳性对照孔检测。
热循环条件设置, 如下 50℃5min 进行 UNG 酶处理, 95℃预变性 10min , 95℃变性 10s,58℃退火延伸 40s ,共 45 个循环。荧光采集阶段在 58℃,40s ,选 择的检测通道为 FAM、 HEX、 ROX、三个通道进行检测, 循环参数设置完毕 , 进行样本参数设置,然后进行 PCR 扩增。扩增完毕后根据内标值的 CT 值和目标 基因的 CT 值进行公式换算 ,可得到目标基因的阳性定量值 。这个需要用到试剂 公司提供的软件。通过对每个型别的各浓度标本进行重复性试验,以观察该试剂
的重复性。
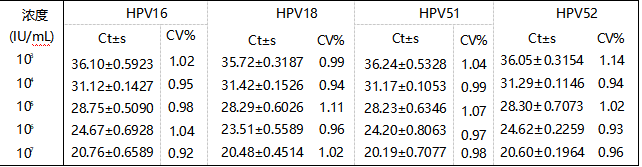
1.4 观察指标
分析高危型 HPV16、HPV18、HPV56、HPV53、HPV51、HPV52、HPV58、 HPV39 各浓度检出的定量值与原始的定量值对比, 计算标准差及变异系数, 来
判断试验的重复性。
![]()
多通道荧光定量 PCR 检测共计检出阳性患者 527 例 ,总检出率达 10.35%。 HPV16 占总阳性标本 9.11%, HPV18 占 4.74%, HPV56 占 5.69%, HPV53 占 9.30%, HPV51 占 7.21% , HPV52 占, 16.89%, HPV58 占 8.53%, HPV39
占 5.50%。
各浓度重复性试验