摘要:
盐城市第一人民医院 江苏 盐城 224001摘 要:帕金森也被称之为震颤麻痹疾病,是影响人体健康的关键退行性病变,且该病患病几率为1.14%,年龄在65岁以上的人群发生率高达2%,且该病呈现出年轻化趋势。临床对帕金森药物进行深入研究,并根据药物发生机制进行分析,制定不同的靶标药物,以此改善症状。关键词盐城市第一人民医院 江苏 盐城 224001
摘 要:帕金森也被称之为震颤麻痹疾病,是影响人体健康的关键退行性病变,且该病患病几率为1.14%,年龄在65岁以上的人群发生率高达2%,且该病呈现出年轻化趋势。临床对帕金森药物进行深入研究,并根据药物发生机制进行分析,制定不同的靶标药物,以此改善症状。
关键词:抗帕金森病;药物;药理作用
相关研究显示,美国帕金森人数大约为150万,每年用于治疗的费用高达100亿美元,且我国男性人数在65岁以上患有帕金森的几率大约为1.7%,女性为1.6%,是老年人群神经系统退行性病变的第二位疾病。同时,帕金森属于一种终身性病变,一旦存在疾病则需终身服用药物进行治疗,药物更是主要的方式,故本文对其进行综述。
一、帕金森概述
帕金森病属于临床上常见的神经系统疾病,患病群体多为中老年人,随着我国人口老龄化的加剧,该病的发病率显著升高[1]。该病的早期特征并不明显,直至中晚期患者表现为非运动并发症或是运动并发症,非运动并发症涵盖抑郁、压疮、嗅觉丧失、味觉异常、记忆力紊乱、肺部感染应及神经功能异常等;运动并发症包括异动症以及症状波动等。该病具有较长的治疗周期,且致残率较高,降低了患者的生活质量以及生存质量。此外,帕金森疾病的发生原因较为复杂,且与年龄、遗传等多个种因素相关。同时,至今仍未发现特效的干预哑药物,临床多以抗胆碱药物、营养神经药物为主,且对患者实施常规治疗以及精心护理后,可以减缓患者的病程发展。由于帕金森属于临床上常见的神经系统疾病,作为慢性疾病的一种,该病具有较高的发病率和致残率,患者患病后的治疗周期较长,再加上患者出院后无法及时得到医护人员的监督管理,多数病人的康复效果较差,甚至出现了其他并发症症状,比如肺部感染、认知功能下降、摔伤、压疮等,严重威胁了患者的生命健康,影响了患者的生存质量[2]。对患者实施药物治疗,可以控制患者的病情发展,缓解患者的症状,延缓病情进展。然而,患者长时间使用药物,常会出现副作用以及并发症,致使大部分患者无法长时间坚持治疗。因此,需积极探索有效的治疗方式,实现缓解患者压力,维持患者生活能力与生活质量的效果,提高预后。
二、拟多巴胺(DA)类药物
(一)DA替代物
为帕金森患者补充脑内DA是当前治疗的直接以及有效措施,但DA在生理PH数值下能以质子化的形式存在,无法经过血脑屏障,故不能直接应用[3]。左旋多巴作为人体内合成DA、NA的前体物质,自身并不存在药理活性,可经血脑屏障进入中枢,且经过多巴脱羧酶转化为DA发挥药理作用,对于改善肌强直以及运动迟缓存在显著效果,且对患者进行持续用药,可以改善震颤、姿势不稳以及吞咽困难等症状。左旋多巴主要是经过D2受体发挥作用,且缓释型以及控释型复方左旋多巴是临床治疗帕金森的主要药物,更是临床研究的热点。
(二)左旋多巴
单胺氧化酶(MAO-B)抑制剂中的丙炔苯丙胺属于一种MAO-B的B型抑制剂,其安全性较高,可以提高人体脑内DA释放,且延长药物作用时间。当前临床内上市的药物为司来吉兰,其是一种选择型MAO-B抑制剂,能够抑制黑质、纹状体内存在的MAO-B,以此降低DA降解程度,提高脑内DA浓度[4]。
儿茶酚胺氧位甲基转移酶(CTMO)抑制剂是一种与左旋多巴代谢存在直接关联的酶,其可以延长血浆内左旋多巴的半衰期,以此稳定血浆浓度,有效改善帕金森患者的运动功能,预防、推迟运动波动以及运动障碍的出现。
(三)DA受体激动剂
DA可以将神经元释放出的左旋多巴在纹状体内经过酶作用脱羧形成DA,且与DA受体结合发挥生理作用。DA受体激动剂能够模拟内源性DA,刺激突触后DA受体,以此减慢D合成以及更新率,降低自由基生成,保护存活的黑质神经元[5]。当前,临床内常见的麦角碱衍生物、非麦角碱类物质,且各个时期开发药物数目较多,可以同时对D1、D2受体激动剂,其是药物发展的关键趋势。
三、抗胆碱类药物
正常基底节内,DA神经递质以及Ach神经递质保持相对平衡,帕金森患者缺少DA则会诱发Ach相对敏感,患者使用抗胆碱药物则可以改善症状。抗胆碱药物的作用机制可以抑制机体纹状体内毒蕈碱样Ach能神经元的输出以及活性,让纹状体DA以及Ach两类递质系统保持相对平衡,以此发挥疗效[6]。抗胆碱药物常与左旋多巴药物合用,常用药物为有苯海索。抗胆碱药物可以抑制纹状体对DA的重吸收以及储存,可以治疗较难控制的震颤,且震颤较为突出的年轻患者早期治疗效果最佳。然而,这一类型药物也存在一定的副作用,多是因外周抗胆碱所致,如口干、散瞳、视力模糊以及心率加快等。
四、腺苷A2A受体拮抗剂
腺苷A2A受体亚型大量表达在棘状神经元内,且信号传递部分主要是通过活化蛋白激酶C、A实现,丝氨酸以及苏氨酸激酶对于帕金森大鼠模型中存在异常活化,可以调节机体谷氨酸受体的磷酸化状态[7]。腺苷A2A受体抑制剂可以降低与DA神经元支配的有关离子型谷氨酸受体的高度磷酸化,以此改善患者的运动障碍。
五、抗帕金森研发药物
当前市面上常见的药物均存在一定的副作用,对帕金森晚期效果不佳,故临床针对更多药物进行研究。
(一)选择性单胺氧化酶抑制药
沙芬酰胺是一种新型药物,其具有多种药物制剂,能可逆性以及高选择性抑制单胺氧化酶药物,可以有效抑制多巴胺再摄取,调节钙通道、阻断电压依赖的钠通道,以此抑制谷氨酸的释放[8]。临床实验期间,对早期帕金森药物患者使用该药物,另一部分药物则需使用安稳药,可以发现患者的运动症状、日常生活能力、认知能力显著改善,且长时间双盲实验发现该药物安全性比较高。同时,这一药物对脑组织内的生物利用度较高,可以有效预防患者出现运动障碍,且耐受性较好。
(二)肾上腺素受体拮抗剂
对患者使用左旋多巴进行治疗时,则会诱发左旋多巴异动症,且治疗较难。菲帕麦唑药物作为一种新型非选择性1-肾上腺素受体拮抗药物,对人体2-肾上腺素受体具有较强的拮抗作用,且临床实验发现,其可以降低左旋多巴的运动波动、异动症,其处于临床实验阶段[9]。
(三)腺苷A2A受体拮抗剂
腺苷A2A受体可以介导腺苷对人体的调节作用,且纹状体内表达水平比较高。腺苷A2A受体拮抗药物可以让降低纹状体-苍白球内的间接通路活性,以此改善帕金森症状。伊曲茶碱可以改善神经元轰动,改善帕金森运动技能,且在帕金森模型内,该药物与左旋多巴、D1或D2受体激动药物联合应用,可以提高帕金森药物作用,尤其是将喹吡罗与左旋多巴联合应用,可以延长药物疗效,且缩短关期,患者用药安全性、耐受性较好。该药物可以单纯用于帕金森药物治疗内,改善患者的精神状态,逆转神经药物所致的木僵[10]。
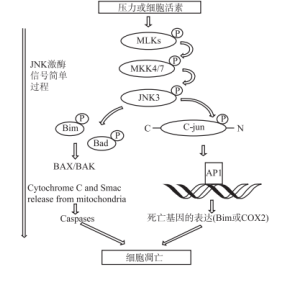
(四)c-氨基末端激酶抑制药物
当前临床科学已经证实c-氨基端激酶(JKN)在神经元细胞凋亡内存在关键作用,可以用于治疗帕金森等退行性疾病药物高度可行性靶标。JKN异常活化能够激动下游信号通路,致使多巴胺导致神经元出现死亡[11]。JKN3激酶作用见图1。美国相关学者研究发现,第一个抑制且可以保护帕金森患者脑细胞活化无的SR-3306,能够有效抑制JKN,且SR-3306在细胞培养、动物模型内存在较好的作用,有效阻断神经元破坏进程,具有较高的应用前景,当前仍处于不断研究阶段[12]。
表1 JKN3 激酶作用
(五)富亮氨酸重复激酶2(LRRK2)
该抑制药物在美国学者研究内发现,该药物基因异常突变可以诱发帕金森,且致病机制主要为线粒体损伤机制,神经毒性机制以及氧化应激等方便,其均与LRRK2编码功能性蛋白存在密切联系,其基因突变可改善LRRK2所致的蛋白功能异常,且神经细胞间信号传导过程内存在较高的整合作用,故LEEK2基因结构异常会对其他信号正确传导产生影响,最终诱发病变。当前,临床研究LRRK2抑制药物,可以通过抑制该基因突变,实现治疗的目的,临床尚处于研究阶段[13]。
(六)非甾体类雌激素β受体选择性激动药物
相关学者对选择性非甾体类雌激素β受体激动药物与当前应用的非选择性雌激素荷尔蒙替代治疗可以实现激活受体的作用,且具有一定的安全性。黑质纹状体系统内,雌激素经过经典ER途径以及非受体途径对多巴胺神经元产生保护作用,以此治疗帕金森药物。通过,诸多大鼠实验模型均显示,该药物安全性较好,具有较高的应用前景,但该药物仍处于临床研究阶段。
结束语:
综上,临床对帕金森药物进行治疗的药物较多,但仍存在部分目标无法实现,如神经保护、治疗运动并发症、运动障碍等。临场内现存药物多为L-多巴胺及其衍生物以及辅助药物,虽然可以稳定病情,但无法控制疾病进展,仅能延缓疾病发生。所以,临床还需展开深入研究,根据患者的实际情况,选择最佳的药物治疗,为患者提供个性化治疗,改善患者的生存率以及生活质量。
参考文献:
[1]王勇,罗思宇,郑雅婷,等. 抗帕金森病药物的自杀风险:基于FAERS数据库的药物警戒研究[J]. 今日药学:1-8.
[2]徐雅楠,赵志刚. 抗帕金森病药物的治疗评价与新药研究进展[J]. 医药导报:1-12.
[3]庞文渊,朱斌,李佳,等. 2014—2019年30家三级医院延缓帕金森疾病进展药物的应用与经济学研究[J]. 医药导报,2022,41(10):1513-1518.
[4]许吉怡,宋汉焘,赵丽姣,等. 泰诺感冒药引起帕金森病相关神经阻滞剂恶性样综合征一例[J]. 中华临床医师杂志(电子版),2021,15(03):236-237.
[5]杜广清,方伯言,刘爱贤,等. 帕金森病患者康复治疗药物利用研究[J]. 中国医药,2020,15(11):1790-1794.
[6]卢靖,朱余兵,潘希丁. 2015—2017年南京市第一医院抗帕金森病药物的使用情况分析[J]. 现代药物与临床,2019,34(09):2817-2821.
[7]潘宇,王亮,王鹏,等. 基于数据挖掘和网络药理学研究国家专利中药复方治疗帕金森病的作用机制[J]. 海南医学院学报,2022,28(24):1896-1903.
[8]王家甜,李亮,袁梦石. 基于数据挖掘探析中药治疗帕金森病的用药规律[J]. 中医临床研究,2022,14(08):15-18.
[9]王文鑫. 中药白芍在帕金森领域的应用及临床研究进展[J]. 医学食疗与健康,2021,19(15):226-227.
[10]皇甫海全,毕尚青,王衍华,等. 中西医治疗帕金森病药理机制研究进展[J]. 湖北中医药大学学报,2021,23(01):122-126.
[11]刘红杰,何涛志,张炅璐,等. 中药复方联合左旋多巴类药物治疗帕金森病的系统评价及基础用药的筛选[J]. 中国中药杂志,2020,45(24):6043-6052.
[12]刘星亮,范磊,宋征宇,娄展. 银杏内酯B通过调控长链非编码RNA MALAT1的表达对MPP~+诱导SH-SY5Y细胞帕金森模型的保护作用[J]. 中药材,2019,42(06):1413-1416.
[13]金蓉蓉. 补阳还五汤对帕金森病大鼠药理作用及JNK通路调控作用研究[J]. 新中医,2019,51(05):72-75.