摘要:
(东莞市松山湖中心医院生殖中心,东莞,523326)【摘要】目的:探讨第三天卵裂较快的胚胎所形成的优质囊胚的发育潜能。方法:收集同一患者第三天及发育速度快的胚胎形成的优质囊胚的培养液并进行代谢组学检测。结果:两组培养液中ATP含量差异显著,发育速度正常组高于发育快组。结论:从能量代谢上看,发育速度正常胚胎形成(东莞市松山湖中心医院生殖中心,东莞,523326)
【摘要】目的:探讨第三天卵裂较快的胚胎所形成的优质囊胚的发育潜能。方法:收集同一患者第三天及发育速度快的胚胎形成的优质囊胚的培养液并进行代谢组学检测。结果:两组培养液中ATP含量差异显著,发育速度正常组高于发育快组。结论:从能量代谢上看,发育速度正常胚胎形成的优质囊胚不一定优于发育速度快的。因此,在同一患者有多个优质囊胚时,根据胚胎形态选择,发育快的胚胎形成的优质囊胚也可作为首选进行移植。
根据Istanbul共识,胚胎培养第二天的卵裂球数目为4细胞、第三天卵裂球数目为8细胞的胚胎具有较高的着床能力[1]。但实际工作中观察到部分患者的胚胎在第三天发育较快(大于10细胞),这些胚胎被认为可能存在卵裂异常[2],即便它们能发育成优质囊胚,却不会被选为优先移植的囊胚。
培养液中胚胎代谢物浓度的变化能反映胚胎的代谢能力,检测到的代谢数据可预测胚胎发育潜力[3]。有研究发现,培养基中丙酮酸和葡萄糖的吸收量被作为胚胎发育潜能的评价指标[4];但研究中并未把代谢组学分析结果与胚胎发育速度相结合,无法得知成功妊娠的胚胎的形态学特征。
因此,本研究通过对优质囊胚的培养液进行的代谢组学分析,探讨第三天卵裂较快的胚胎形成的优质囊胚的发育潜能。
资料与方法
一、研究对象
选取2021年10月1日至2022年1月30日在东莞市松山湖中心医院生殖中心进行助孕的患者。纳入标准:①女方年龄≤38岁;②同一患者的D3胚胎同时有7~9细胞和≥10细胞,且碎片率≤10%;③D3有7~9细胞和≥10细胞的胚胎行囊胚培养且有优质囊胚形成。
二、研究方法
1、超促排卵及取卵 患者使用的促排方案为标准长方案或拮抗剂方案。根据B超监测卵泡发育情况、性激素血清学指标决定HCG日,肌注HCG 35~37小时后进行取卵,HCG 40小时后进行受精。
2、胚胎培养 将受精后的胚胎放置于37℃,6% CO2培养箱内进行单胚胎培养。D3培养后,将胚胎转至囊胚培养液(50μL)进行单囊胚培养。
3、胚胎评分 D3胚胎评分:Ⅰ级-卵裂球大小均匀,碎片<10%;Ⅱ级-卵裂球大小均匀,碎片10~20%;Ⅲ级-卵裂球大小不均匀,碎片≤20%;Ⅳ-碎片20~50%;Ⅴ级-碎片≥50%。囊胚评分:卵裂期无多核现象、内细胞团及滋养层评分均不含C的3期以上囊胚为优质囊胚。本研究的优质囊为第五天4期以上的AA,AB,BA级囊胚。
4、培养液收集 优质囊胚进行移植或冷冻后,收集同一患者D5优质囊胚的废弃囊胚培养液50μL并转入灭菌EP管中,﹣80℃保存。再根据D3的细胞数分为D3发育速度正常胚胎(细胞数7~9)形成的优质囊胚培养液组(D5N),以及D3发育较快胚胎(细胞数≥10)形成的优质囊胚培养液组(D5F)。
5、样本检测 将收集好的囊胚培养液样本装入干冰泡沫盒中,送至上海拜谱生物科技有限公司,针对200种常见初级代谢产物(P200),利用高效液相色谱/质谱法,对样本进行靶向代谢组学分析。
6、统计分析
检测结果采用丰度分析,其显著性差异分析使用Student’s t-test。
结 果
本研究采用同一患者来源不同的优质囊胚培养液进行自身对比。优质囊胚均为D5,4~5期AA、BA、AB级囊胚。分别收集两组囊胚培养液各14份进行代谢物检测。
在能量代谢上,检测出两组囊胚培养液的ATP含量差异显著,D5N组显著高于D5F组(P=0.048,图1)。
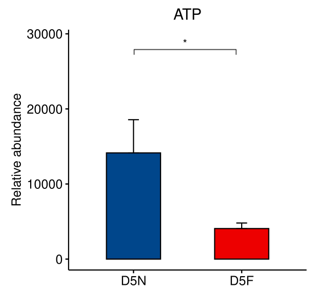
图1:ATP丰度分析图
讨 论
在人们传统的认知中,符合Istanbul共识的胚胎发育速度的胚胎或囊胚应有较好的发育潜能。当同一名患者同时有由第三天8细胞发育而来的4BA/4AB囊胚和≥10细胞发育而来的4AA囊胚时,更多的胚胎学家会把前者定为最优选择。有研究者用时差观察系统发现,胚胎在受精后到达8细胞的时间小于61.7h时会有更高的植入率[5]。因此,在我们观察第三天胚胎时(67~69h)便会观察到大于8细胞的胚胎,即表现出快速卵裂。所以,标准胚胎观察时间点不一定能说明特定的细胞事件。还有研究认为,在囊胚阶段,第5天的囊胚形态特征本身比之前的卵裂模式更重要,囊胚的形态才可更进一步预测妊娠结局[6],而在AA/AB/BA级囊胚中,第3天的卵裂球数量对妊娠结局并没有影响[7]。因此,对于第三天发育快的胚胎形成的优质囊胚应该要有新的认识。
在本研究中,我们通过代谢组学检测了两组囊胚培养液。结果发现D5F组培养液中的ATP含量低于D5N组。ATP是细胞利用能源物质(如葡萄糖)在线粒体中产生的一种不稳定的高能磷酸化合物,它为细胞各项生命活动直接供能。胚胎在融合之后,因为囊胚腔的形成和不断扩大需要更多的能量[8]。糖酵解产生的丙酮酸进入线粒体参与三羧酸循环,生产更多的ATP供囊胚继续发育,因此,ATP应该在细胞内不断的产生和利用以保证最直接的能量供应。
而在培养液中检测出的ATP,可能是由受损或死亡的细胞中被释放出来,或是在受到物理应力的作用下,如质膜拉伸,渗透膨胀或收缩等,引起细胞发生ATP的释放[9]。D5N组的培养液中ATP含量较高,可能因为:1、滋养层或内细胞团中有少量的不易被发现的受损细胞引起ATP释放。但根据形态学评分标准仍可评为优质囊胚;2、囊胚的膨胀和收缩引起ATP释放。囊胚在囊胚腔形成以后不断膨胀扩大,滋养层细胞不断增多。在这个过程中,囊胚腔会发生不同程度的重复收缩及膨胀。有研究显示,囊胚腔的弱收缩(体积减少不到20%)在孵化过程中起着重要作用,而强收缩(体积减少20%或以上)有抑制孵化的作用,且收缩次数较多对囊胚发育也有不利影响[10],因此,囊胚腔有强收缩或收缩次数较多则引起滋养层细胞运动加剧,可能导致更多的ATP释放出培养液。多个中心研究数据表明,即便同为AA级的囊胚,其囊胚腔收缩程度也会有所不同,发生收缩的AA级囊胚的种植率低于未发生收缩的AA级囊胚[11]。综上所述,D5N组的优质囊胚不一定优于D5F组。
本研究从ATP的结果中可以看出,D3正常发育胚胎形成的优质囊胚不一定就优于发育快胚胎形成的优质囊胚。因此,D3发育较快胚胎形成的最优囊胚也可作为首选移植的胚胎。本研究采用同一患者的优质囊胚进行比较,排除了混杂因素。因D3发育慢的胚胎(小于6细胞)囊胚形成率低,并未纳入研究;且样本量小且没有与妊娠结局相联系,是本研究的不足之处。在未来的研究中,应综合分析三大营养素的代谢产物情况,并结合妊娠结局,对D3不同发育速度的胚胎形成的优质囊胚做进一步的评判。
作者姓名:李青洋,硕士,助理研究员,女,专业方向:生殖医学
【参 考 文 献】
[1] Alpha Scientists in Reproductive Medicine and ESHRE Special Interest Group of Embryology. The Istanbul consensus workshop on embryo assessment[J]. Human Reproduction, 2011, 26(6):p.1270-1283.
[2] Magli M C , Gianaroli L , Ferraretti A P , et al. Embryo morphology and development are dependent on the chromosomal complement[J]. Fertility & Sterility, 2007, 87(3):534-541.
[3] Montskó, Gergely, Zrínyi, Zita, Janáky, Tamás, et al. Noninvasive embryo viability assessment by quantitation of human haptoglobin alpha-1 fragment in the invitro fertilization culture medium: an additional tool to increase success rate[J]. Fertility & Sterility, 2015, 103(3):687-693.
[4] David K, Gardner, Petra L, et al. Glucose consumption of single post-compaction human embryos is predictive of embryo sex and live birth outcome. [J]. Human reproduction (Oxford, England),2011,26(8):1981-6.
[5] Carrasco, Arroyo, Gil, et al. Selecting embryos with the highest implantation potential using data mining and decision tree based on classical embryo morphology and morphokinetics[J]. J ASSIST REPROD GEN, 2017, 2017,34(8):983-990.
[6] Guerif F, Lemseffer M, Leger J, et al. Does early morphology provide additional selection power to blastocyst selection for transfer? [J]. Reproductive Biomedicine Online, 2010, 21(4):510-519.
[7] Shen X, Long H, Gao H, et al. The Valuable Reference of Live Birth Rate in the Single Vitrified-Warmed BB/BC/CB Blastocyst Transfer: The Cleavage-Stage Embryo Quality and Embryo Development Speed[J]. Frontiers in Physiology, 2020, 11:1-10.
[8] Gardner D K, Wale P L. Analysis of metabolism to select viable human embryos for transfer[J]. Fertility & Sterility, 2013, 99(4):1062-1072.
[9] Burnstock G, Knight G E. Cell culture: complications due to mechanical release of ATP and activation of purinoceptors [J]. Cell & Tissue Research, 2017.
[10] Julian, Marcos, Sonia, et al. Collapse of blastocysts is strongly related to lower implantation success: a time-lapse study[J]. Human reproduction (Oxford, England), 2015, 30(11):2501-8.
[11] Sciorio R, Saura R H, Thong K J, et al. Blastocyst collapse as an embryo marker of low implantation potential: A time-lapse multicentre study[J]. Zygote, 2020, 28(2):1-9.